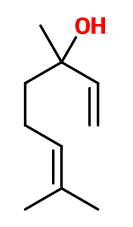
Crédits photo: ScenTree SAS
| Entreprise | Nom de l'ingrédient | ID | Commentaires | Naturalité | Certifications | Pureté | Nom latin | Partie traitée | Origine géographique | MOQ |
|---|---|---|---|---|---|---|---|---|---|---|
|
|
Linalol - 30 Gr | - |
Visit website
|
- | - | - | - | - | - | |
|
|
Linalool | 30034999 |
Visit website
|
Molecule | - | - | - | - | - | |
|
|
Linalool BMBcert™ | 30786546 |
Visit website
|
Molecule | - | - | - | - | - |
Général
-
N° CAS : 78-70-6
-
N° EINECS : 201-134-4
-
N° FEMA : 2635
-
N° FLAVIS : 02.013
-
N° JECFA : 356
-
Aspect : Liquide incolore
-
Densité : 0,862
-
Tenue : Tête/Coeur
-
Gamme de prix : €
Physico-chemical properties
-
Formule brute : C10H18O
-
Masse molaire : 154,25 g/mol
-
Log P : 2,7
-
Point de fusion : 81°C
-
Point d'ébullition : 199°C
-
Seuil de détection : 6 ppb (0,0000006%)
-
Optical rotation : Donnée indisponible
-
Pression vapeur : Donnée indisponible
-
Indie de réfraction @20°C : Donnée indisponible
-
Valeur d'acide : Donnée indisponible.
-
Point éclair : 81°C
Utilisations
Utilisations :
Le Linalol apporte richesse et naturalité aux notes florales. Utilisé dans plusieurs reconstitutions florales pour un apport de fraicheur et de caractère. Le Linalol est l'une des molécules les plus utilisées de la parfumerie.
Découverte :
Synthétisé pour la première fois en 1919. Le Linalol lévogyre avait tout de même été utilisé pour la première fois, extrait du bois de rose, dans Jicky (1889), de Guerlain.
Présence dans la nature :
Le Linalol peut être extrait de nombreux composés naturels, tant il est très fortement présent dans la nature. Le Linalol lévogyre est présent jusqu'à 85% dans le Bois de Hô HE (bois de camphrier) et à 80% environ dans le Bois de Rose HE. Le Linalol dextrogyre est présent jusqu'à 70% dans la Coriandre Graines HE.
Isoméries :
La différence d'odeur entre les deux énantiomères du Linalol est assez faible. Le Linalol lévogyre (Licareol) est néanmoins plus boisé. Dans la majeure partie des cas, c'est le mélange racémique des deux énantiomères (le Linalol dextrogyre est appelé Coriandrol) qui est utilisé en parfumerie. Plusieurs isomères de constitution du Linalol existent. Le Géraniol, le Nérol, l'Eucalyptol et l'Oxyde de rose en font partie, mais ont des odeurs bien différentes les uns des autres.
Précurseurs de synthèse :
Le Linalol est le précurseur de la synthèse de nombreux composés d'intéret olfactif. En milieu acide, le Linalol s'isomérise en Géraniol, Nérol et Alpha-Terpinéol. La présence d'acide chromique face au Linalol l'oxyde en Citral. L'Oxyde de linalol est obtenu par oxidation de ce dernier en présence d'acide peracétique. Une hydrogénation catalytique du Linalol permet de synthétiser le Tétrahydrolinalol. Enfin, plusieurs esters du Linalol existent : l'Acétate de linalyle reste le plus utilisé et réputé de tous.
Voies de synthèse :
Le Linalol en lui-même peut être produit de plusieurs manières différentes. Une première voie de synthèse part de l'Alpha-pinène, hydrogéné en Pinane par voie catalytique. Le Pinane est ensuite oxygéné à nouveau par voie catalytique pour donner un mélange d'hydropéroxydes de Pinane cis et trans. Une nouvelle hydrogénation catalytique permet de synthétiser le cis et le trans-Pinanol, séparés par distillation fractionnée. Une pyrolyse des deux composés séparés permet d'obtenir les deux isomères du Linalol séparément. L'Alpha-pinène lévogyre synthétise le Linalol dextrogyre et l'Alpha-pinène dextrogyre synthétise le Linalol lévogyre. Une autre voie synthèse utilise le Myrcène, synthétisé à partir du Pinène-béta. Un hydrohalogénation du Myrcène amène la formation de chlorure de géranyl, de néryl et de linalyl. La réaction de ce mélange avec le chlorure de cuivre (I) donne de l'Acétate de linalyle avec 80% de rendement environ. Le Linalol est alors obtenu par saponification. Enfin, le 6-Methyl-5-hepten-2-one, produit de plusieurs manières possibles, est converti en Linalol par réaction avec l'éthylène, synthétisant du Déshydrolinalol, suivie d'une hydrogénation catalysée par le catalyseur au palladium de Lindlar.
Réglementation & IFRA
Allergènes :
Cet ingrédient ne contient pas d'allergènes.
51ème amendement :
Cet ingrédient est réglementé par le 51ème amendement
-
Specified ingredients: notes
Oxidation products of Linalool, especially hydroperoxides, have been demonstrated to be potent sensitizers. d-, l- and dl-Linalool and natural products containing substantial amounts of it, should only be used when the level of (hydro)peroxides is kept to the lowest practical level, for instance by adding antioxidants at the time of production. The addition of 0.1% BHT or α-Tocopherol for example has shown great efficiency. Such products should have a peroxide value of less than 20 millimoles per liter, determined according to the IFRA analytical method for the determination of the peroxide value, which can be downloaded from the IFRA website (www.ifrafragrance.org).
Contributions from other sources
Natural products known to be rich in Linalool include bois de rose, coriander or ho wood oil.


