Crédits photo: ScenTree SAS
| Entreprise | Nom de l'ingrédient | ID | Commentaires | Naturalité | Certifications | Pureté | Nom latin | Partie traitée | Origine géographique | MOQ |
|---|---|---|---|---|---|---|---|---|---|---|
|
|
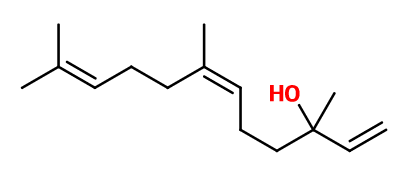
Nerolidol | 30034996 |
Visit website
|
Molecule | - | - | - | - | - |
Général
-
N° CAS : 7212-44-4
-
N° EINECS : 230-597-5
-
N° FEMA : 2772
-
N° FLAVIS : 02.018
-
N° JECFA : 1646
-
Aspect : Liquide incolore
-
Densité : 0,874
-
Tenue : Tête
-
Gamme de prix : €€
Propriétés physico-chimiques
-
Formule brute : C15H26O
-
Masse molaire : 222,37 g/mol
-
Log P : 5
-
Point de fusion : Donnée indisponible.
-
Point d'ébullition : 276°C
-
Seuil de détection : De l'ordre de 10 ppb à 10 ppm (0,0001%) selon les personnes
-
Optical rotation : Donnée indisponible
-
Pression vapeur : Donnée indisponible
-
Indice de réfraction @20°C : Donnée indisponible
-
Valeur d'acide : Donnée indisponible.
-
Point éclair : 125°C
Utilisations
Utilisations :
Le Nérolidol est utilisé dans tous types de parfumerie pour des notes orangées, rosées, chèvrefeuille, muguet. Utile dans les accords hespéridés et boisés-vanillés, pour donner un côté aérien et servir de liant.
Découverte :
Découvert en 1923
Présence dans la nature :
Le trans-Nérolidol dextrogyre est le composé majoritaire du Cabreuva HE (84%), arbuste du Paraguay. Ce même nérolidol dextrogyre est isolé du Dalbergia parviflora, une liane asiatique.
Isoméries :
Le Nérolidol existe sous la forme de deux paires d'énantiomères, tant il a un carbone asymétrique et une double liaison donnant naissance à deux diastéréoisomères. Le Nérolidol synthétique est cependant un mélange de tous ces isomères. Tous ont une odeur similaire, mais pas les mêmes propriétés physico-chimiques.
Précurseurs de synthèse :
Le Nérolidol peut être précurseur de la synthèse d'autres terpènes, par réaction de Diels Alder par exemple. Il est aussi précurseur de la synthèse du Farnésol par isomérisation.
Voies de synthèse :
Le Nérolidol est un sesquiterpène, souvent associé au Linalol, dont la synthèse part de ce dernier. Le Linalol est converti en géranylacétone par réaction avec l'Acétoacétate d'éthyle par exemple. Une condensation de la cétone obtenue avec l'acétylène, suivie d'une hydrogénation catalysée au palladium de Lindlar permet d'obtenir le Nérolidol.
Réglementation & IFRA
Allergènes :
Cet ingrédient ne contient pas d'allergènes.
51ème amendement :
Cet ingrédient n'est pas réglementé par le 51ème amendement

