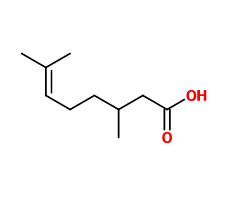
Crédits photo: ScenTree SAS
Si vous souhaitez référencer les produits de votre société ici,
merci de rentrer en contact avec l'adresse mail suivante fournisseurs@scentree.co pour en savoir plus sur nos offres dédiées aux annonceurs.
Si vous souhaitez référencer les produits de votre société ici,
merci de rentrer en contact avec l'adresse mail suivante fournisseurs@scentree.co pour en savoir plus sur nos offres dédiées aux annonceurs.
Général
-
N° CAS : 502-47-6
-
N° EINECS : 207-939-7
-
N° FEMA : 3142
-
N° FLAVIS : 08.036
-
N° JECFA : 1221
-
Aspect : Liquide incolore
-
Densité : 0,93
-
Tenue : Coeur/Fond
-
Gamme de prix : €€€
Physico-chemical properties
-
Formule brute : C10H18O2
-
Masse molaire : 170,25 g/mol
-
Log P : 2,84
-
Point de fusion : Donnée indisponible.
-
Point d'ébullition : 257°C
-
Seuil de détection : Donnée indisponible.
-
Optical rotation : Donnée indisponible
-
Pression vapeur : Donnée indisponible
-
Indie de réfraction @20°C : Donnée indisponible
-
Valeur d'acide : Donnée indisponible.
-
Point éclair : 163,2°C
Utilisations
Utilisations :
Découverte :
Donnée indisponible.
Présence dans la nature :
Trouvé dans la cardamome
Isoméries :
L'Acide citronellique possède un carbone asymétrique donnant naissance à deux énantiomères possibles pour cette molécule. C'est néanmoins un mélange de ses isomères qui est utilisé en parfumerie.
Précurseurs de synthèse :
L'Acide citronellique est utilisé pour la synthèse de plusieurs esters citronelliques. Une réaction catalysée avec l'éthanol permet par exemple de former le Citronellate d'Ethyle. Ce type de composés peut alors servir à synthétiser un autre composé utilisé en parfumerie.
Voies de synthèse :
L'Acide citronellique est synthétisé par oxydation du Citronellal. Cette synthèse peut utiliser une réaction d'Oxydation de Pinnick. Cette oxydation a lieu en deux étapes. La première est la formation d'acide chloreux par réaction entre le chlorite de sodium et le dihydrogénophospate de sodium. La deuxième étape met en contact l'acide chloreux avec le Citronellal, rendant son carbone fonctionnel plus éléctrophile. Il peut donc subir une attaque nucléophile par l'ion chlorite formé. Un dégagement d'acide hypochloreux lors d'un mécanisme concerté permet enfin de former l'acide citronellique.
Réglementation & IFRA
Allergènes :
Cet ingrédient ne contient pas d'allergènes.
51ème amendement :
Cet ingrédient n'est pas réglementé par le 51ème amendement

