Crédits photo: ScenTree SAS
Si vous souhaitez référencer les produits de votre société ici,
merci de rentrer en contact avec l'adresse mail suivante fournisseurs@scentree.co pour en savoir plus sur nos offres dédiées aux annonceurs.
Si vous souhaitez référencer les produits de votre société ici,
merci de rentrer en contact avec l'adresse mail suivante fournisseurs@scentree.co pour en savoir plus sur nos offres dédiées aux annonceurs.
Général
-
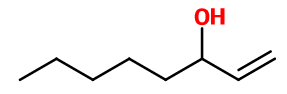
N° CAS : 3391-86-4
-
N° EINECS : 222-226-0
-
N° FEMA : 2805
-
N° FLAVIS : 02.023
-
N° JECFA : 1152
-
Aspect : Liquide incolore
-
Densité : 0,835
-
Tenue : Coeur
-
Gamme de prix : €€€
Propriétés physico-chimiques
-
Formule brute : C8H16O
-
Masse molaire : 128,22 g/mol
-
Log P : 2,7
-
Point de fusion : -49°C
-
Point d'ébullition : 180°C
-
Seuil de détection : Seuil de détection : 14 ppb (0,0000014%)
Seuil de reconnaissance : 25 ppb (0,0000025%)
-
Optical rotation : Donnée indisponible
-
Pression vapeur : Donnée indisponible
-
Indice de réfraction @20°C : Donnée indisponible
-
Valeur d'acide : Donnée indisponible.
-
Point éclair : 63°C
Utilisations
Utilisations :
L'1,3-Octènol est utilisé principalement dans des accords champignon, lavande, dans des notes boisées et alimentaires.
Découverte :
Donnée indisponible.
Présence dans la nature :
L'énantiomère (R) de l'1,3-Octènol est présent à 97% dans le principe aromatique des champignons de Paris et à 89% dans celui des chanterelles. Néanmoins, l'1,3-Octènol ne fait pas l'objet d'extractions à l'état naturel.
Isoméries :
L'énantiomère (R) de l'1,3-Octènol est plus puissant que l'énantiomère (S), qui possède une odeur de légumes. En parfumerie, le mélange des deux isomères est le plus utilisé.
Précurseurs de synthèse :
L'1,3-octènol peut être précurseur de la synthèse d'esters obtenus par réaction entre cet alcool et un acide carboxylique.
Voies de synthèse :
L'1,3-Octènol peut être préparé par une réaction de Grignard, faisant réagir le bromure de vinylmagnésium avec l'hexanal.
Réglementation & IFRA
Allergènes :
Cet ingrédient ne contient pas d'allergènes.
51ème amendement :
Cet ingrédient n'est pas réglementé par le 51ème amendement

